Elución de iones de níquel desde esferas de alginato en un medio ácido
Alvaro Aracenaa,*, Francisco Cárcamoa, Óscar Jerezb, Robinson Constanzoa
aPontificia Universidad Católica de Valparaíso, Escuela de Ingeniería Química, General Cruz 34, Valparaíso, Chile
bUniversidad de Concepción, Instituto de Geología Económica Aplicada (GEA), Casilla 160-C, Concepción, Chile
*Autor para la correspondencia: alvaro.aracena@pucv.cl
| |
RESUMEN
Se estudió la elución de iones de níquel desde esferas de alginato en un intervalo de temperaturas de 2 a 80 °C y una concentración
de ácido sulfúrico entre 0,005 a 2,5 g L−1. El mecanismo de elución fue establecido por intercambio iónico entre protones e iones de níquel alcanzando valores de elución
de 93% a una temperatura de 80 °C y concentración de H2SO4 de 0,25 g L−1. También se estudió la influencia de otros ácidos sobre la elución de níquel. La velocidad de elución de níquel fue significativamente
influenciada por la temperatura y concentración de H2SO4. La cinética de elución de iones de níquel fue estudiada y el modelo 1-(1-α)1/3=kappt describió muy bien la cinética de esta reacción. La dependencia de la elución de níquel sobre la concentración de ácido
sulfúrico fue del orden de 0,33. Además, fueron determinadas las constantes de velocidad intrínseca y se obtuvo un valor de
energía de activación de 54,5 kJ mol−1 para el intervalo de temperaturas estudiado. Los resultados indicaron que el proceso de elución de níquel fue controlado
por reacciones químicas.
|
| |
ABSTRACT
Elution of nickel ions from alginate beads in an acid media. Elution of nickel ions from alginate beads was studied in a temperature range of 2 to 80 °C and a sulfuric acid concentration
between 0.005 to 2.5 g L−1. The elution mechanism was established by ion exchange between nickel and ions protons, obtaining a value of 93% elution
at a temperature of 80 °C and a H2SO4 concentration of 0.25 g L−1. The influence of other acids on nickel elution was also studied. The nickel elution rate was significantly influenced by
temperature and concentration of H2SO4. Elution kinetics of nickel ions was studied, and the 1-(1-α)1/3=kappt model properly described the kinetics of this reaction. The dependence of nickel elution on the sulfuric acid concentration
was of the order of 0.33. Moreover, the intrinsic rate constants were determined and an activation energy value of 54.5 kJ
mol−1 was obtained for the temperature range studied. The results indicated that the nickel elution is a process controlled by
chemical reactions.
|
1. INTRODUCCIÓNTOP
Industrias involucradas en la metalurgia, eléctrica y electrónica, minería y fundición, industria del chapado de metales,
entre otros, liberan metales pesados hacia las aguas residuales, causando un daño al ecosistema (Xia et al., 2014). Tales aguas residuales necesitan ser tratadas para disminuir el impacto ambiental. El níquel es uno de los metales liberados
y, al igual que con otros metales de transición, es muy tóxico para los humanos y otros organismos (Anoop et al., 2011; Belova et al., 2014). Consecuentemente, es necesario eliminar estos metales para asegurar adecuadamente un efluente de calidad para varios usos
(Malanis y Katsou, 2013), ya que además pueden reducir la eficiencia de tratamientos biológicos (Vocciante et al., 2014). Existen algunos procesos para la extracción de metales pesados desde aguas residuales que incluyen precipitación química,
adsorción, intercambio iónico, flotación, filtración por membrana, tratamiento electroquímico y coagulación-floculación (O’Connell et al., 2008). Los procesos de adsorción e intercambio iónico pueden ser utilizados para la extracción de metales pesados tal como los
iones de níquel. La ventaja competitiva de tales procesos aumenta cuando se utilizan por el bajo costo de tratamiento. Los
materiales poliméricos naturales tales como esferas de alginato, que es un sorbente que tiene tamaño controlado, buenas propiedades
físicas y químicas y alta porosidad, han mostrado su utilidad para la extracción de metales pesados tales como cadmio (Ibáñez
y Umetsu, 2008), zinc (Ibáñez y Aracena, 2014), níquel (Aracena et al., 2015), entre otros.
Aracena et al. (2015) demostró que utilizando las esferas protonadas secas de alginato (PDAB en inglés) se puede extraer Ni2+ desde soluciones muy diluidas. Se alcanzó un valor de extracción de iones de níquel de 75,9 mg g−1 de alginato seco a pH=5,0 y un tiempo de 360 minutos. El mecanismo de extracción fue por intercambio iónico entre los iones
de níquel y protones provenientes de los grupos funcionales de las esferas de alginato. Lamentablemente, no se realizaron
estudios sobre la elución de níquel para conocer los parámetros que afectan en la desorción de este elemento desde el PDAB.
Hay que destacar además que no existen estudios bibliográficos sobre elución de iones de níquel.
Este trabajo de investigación tiene como objetivo estudiar los mecanismos de elución de iones de níquel desde las esferas
de alginato bajo condiciones experimentales tales como agitación, temperatura, concentración de ácido sulfúrico y diferentes
ácidos.
1.1. Química y mecanismo de elución de Ni2+TOP
Se realizó un estudio termodinámico para conocer la solubilidad de los constituyentes del níquel. Los diagramas de fases electroquímicos
(diagramas Eh-pH) son muy utilizados para predecir las condiciones de estabilidad o inestabilidad de minerales en contacto
con soluciones acuosas. Por esta razón se construyó el diagrama Eh-pH para el sistema Ni-H2O a una temperatura de 2, 25 y 80 °C considerando la concentración de níquel de 0,00029 mol L−1. Los datos termodinámicos utilizados en la construcción de este diagrama en equilibrio fueron obtenidos principalmente desde
la base de datos del programa HSC Chemistry (Roine, 1999). Los componentes de níquel presentes en este diagrama fueron el Ni2+, NiO, NiH0.18 y NiO·OH. La Fig. 1 muestra el diagrama de equilibrio del sistema Ni-H2O a 2, 25 y 80 °C. En este diagrama se observa que el área de predominancia del Ni2+, ión fundamental en el intercambio iónico, está sobre los valores de potencial de −0,25 volts y valores de pH ácidos (pH<6,0).
A medida que se incrementaba la temperatura, el área de predominancia del catión níquel se volvió más amplio. Así, para una
temperatura de 2 y 80 °C, las líneas de equilibrio entre el Ni2+ y NiO(ac) se encuentra a valores de pH de 3,5 y 5,7, respectivamente. En cambio, los rangos de Eh (línea de equilibrio entre Ni2+ y NiH0.68) se mantienen con pequeñas diferencias a pesar del incremento de la temperatura.
|
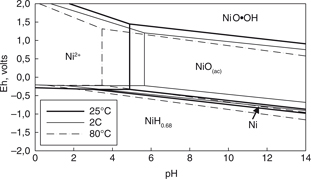 Figura 1. Diagrama Eh-pH del sistema Ni-H2O a una concentración de Ni=2,9×10−4 mol L−1. Líneas finas: equilibrios obtenidos a 2 °C. Líneas gruesas: equilibrios obtenidos a 25 °C. Líneas Entrecortadas: equilibrios
obtenidos a 55 °C. Figura 1. Diagrama Eh-pH del sistema Ni-H2O a una concentración de Ni=2,9×10−4 mol L−1. Líneas finas: equilibrios obtenidos a 2 °C. Líneas gruesas: equilibrios obtenidos a 25 °C. Líneas Entrecortadas: equilibrios
obtenidos a 55 °C.
|
|
En el rango de pH estudiado, en donde predomina el ión níquel (Ni2+), se puede concluir que es posible que se presente un mecanismo de intercambio iónico el cual sería viable desde una temperatura
entre 2 a 80 °C para un rango de pH ácido. Por lo tanto, este intercambio iónico puede ser representado por la reacción (1):
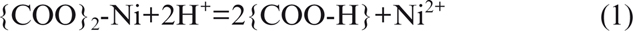
2. MATERIALES Y MÉTODOSTOP
Todos los agentes utilizados fueron de alta pureza y no se necesitó de un tratamiento adicional. Para los trabajos desarrollados
de extracción y elución, los análisis químicos fueron hechos por espectroscopía de absorción atómica (EAA). Las soluciones
con diferentes concentraciones de níquel fueron preparadas disolviendo NiSO4*6H2O en agua doblemente destilada. Para el análisis de la composición química y morfológica de las esferas de alginato se utilizó
un microscopio electrónico de barrido (SEM) y un detector de energía dispersiva (EDS). Para la observación y análisis de las
muestras de esferas de alginatos, éstas fueron cortadas con oro y grafito, respectivamente. Las esferas protonadas secas de
alginato (PDAB) fueron generadas de acuerdo al protocolo descrito previamente (Ibáñez y Umetsu, 2002). Las cadenas de ácido algínico son entrecruzados con calcio y bario para generar PDAB-Ca y PDAB-Ba, que han mostrado propiedades
químicas y físicas apropiadas en soluciones acuosas (Ibáñez y Umetsu, 2002). La formación del PDAB produce una superficie corrugada con un diámetro de esfera de alrededor de 1,0±0,1 mm el cual tiene
una alta porosidad. Las esferas protonadas secas de alginato son estables en un alto rango de pH para valores de aproximadamente
entre 1 y 6, después de este valor el calcio y bario son liberados desde las esferas, en donde el alginato pierde rigidez
y estabilidad.
2.1. Trabajo de extracción de iones de níquelTOP
Los experimentos de extracción se realizaron poniendo en contacto 400 mL de una solución de níquel a una concentración de
17 mg L−1 con 80 mg de PDAB durante un tiempo de 360 minutos a 25,0±0,1 °C. El pH de la solución se mantuvo constante por la adición
de solución de NaOH. En cada experimento se extrajo 1 mL de muestra a diferentes intervalos de tiempo para ser enviadas a
EAA. Las muestras eran diluidas a 10 mL con agua doblemente destilada y luego filtradas a través de filtros de membranas de
celulosa. Las concentraciones remanentes de iones de níquel, bario y calcio en los filtrados eran analizadas por EAA. Las
esferas eran recopiladas al final de los experimentos, en donde fueron lavadas consecutivamente con agua doblemente destilada,
secadas con aire y almacenadas para observaciones por SEM-EDS.
2.2. Elución de iones de níquelTOP
Los experimentos de elución isotérmicos de tipo Batch fueron realizados en un reactor de vidrio de 2 L equipado con un agitador
mecánico variable, una manta calefactora, un termopar, un tubo poroso para muestras líquidas y un condensador enfriado por
agua para minimizar las pérdidas de solución por evaporación. El volumen de solución utilizado fue de 400 mL. La concentración
de ácido sulfúrico fue variable (desde 0,005 a 2,5 g L−1). 80 mg de las esferas de alginato cargadas con níquel se pusieron en contacto con la solución de ácido sulfúrico a una temperatura
variable (desde 2 a 80 °C). Se extrajeron muestras de 1 mL cada cierto tiempo y se diluyeron a 10 mL con agua doblemente destilada.
Las concentraciones de Ni, Ba y Ca se analizaron por EAA. Las esferas se recuperaron, lavaron, secaron y se analizaron mediante
SEM-EDS.
Los experimentos de extracción y elución se realizaron por duplicado y triplicado, respectivamente. Las variaciones en los
resultados fue, en todos los casos, inferior al 2%. Los valores presentados en este trabajo, son por tanto, valores promedio.
3. RESULTADOS Y DISCUSIÓNTOP
Algunas de las principales variables estudiadas que afectaron a la cinética de elución de níquel desde el PDAB fueron: velocidad
de agitación, temperatura, concentración de ácido sulfúrico y diferentes ácidos. Pero primero se mostrarán algunos resultados
de extracción de níquel como también análisis del alginato.
3.1. Prueba de carga del PDAB (extracción)TOP
Se realizaron pruebas de cargas del alginato con iones de níquel. Se utilizó una concentración inicial de Ni=17 mg L−1, un valor de pH de 5,0, una masa de alginato de 80 mg y una temperatura de 25 °C. Los resultados se muestran en la Fig. 2 como concentración de níquel en función del tiempo experimental. En esta figura se puede observar un importante decrecimiento
de la concentración de níquel en solución en función del tiempo experimental, en donde no se asocia la liberación de bario
o calcio. Tal comportamiento ya fue demostrado y explicado en un trabajo realizado por Aracena et al. (2015). En resumen, el proceso de extracción se debe a un mecanismo de intercambio iónico en el que se intercambian los protones
de los grupos funcionales del PDAB e iones de níquel de la solución.
|
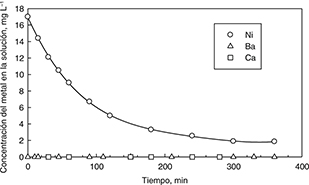 Figura 2. Datos de extracción típicos de concentración residual de Ni en la solución. Condiciones de trabajo de concentración
inicial de Ni=17,0 mg L−1, pH=5.0 y PDAB=80 mg. Figura 2. Datos de extracción típicos de concentración residual de Ni en la solución. Condiciones de trabajo de concentración
inicial de Ni=17,0 mg L−1, pH=5.0 y PDAB=80 mg.
|
|
La extracción de iones de níquel alcanzó un valor de alrededor de 77 mg g−1 de PDAB (peso seco) después de 360 minutos de tiempo de contacto. Por lo tanto, y en base a estos resultados, cada vez que
se realizaba un experimento de elución, se debía pasar por este paso de carga del alginato con las mismas condiciones experimentales.
Para evidenciar la cantidad de níquel que se encontraba intercambiado en el alginato, se analizó la composición de este elemento
a través de las esferas de alginato usando un análisis por topografía de superficie (BEI) con cuantificación por EDS. El perfil
de concentración de níquel fue a través de la partícula de alginato y fue medida a lo largo de la línea punteada presentada
en la Fig. 3. Los valores de las mediciones están dados en la Tabla 1 como porcentaje de níquel en cada punto analizado. Estos resultados indicaron que la concentración de níquel a través de
la esfera de alginato es alta en la superficie externa. Este comportamiento es consistente con una alta extracción de níquel
desde las soluciones. Por lo tanto, esta cantidad de níquel en el alginato evidencia la extracción de iones de níquel desde
soluciones diluidas con esferas de alginato.
|
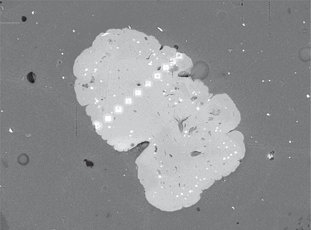 Figura 3. Análisis por topografía de superficie (BEI) con cuantificación por EDS de una esfera cortada de alginato para una
muestra tratada. La concentración de Ni fue medida a lo largo de la línea punteada. Figura 3. Análisis por topografía de superficie (BEI) con cuantificación por EDS de una esfera cortada de alginato para una
muestra tratada. La concentración de Ni fue medida a lo largo de la línea punteada.
|
|
Tabla 1. Perfil de concentración de Ni a través del alginato por EDS
| Punto |
Concentración de Ni (%) |
| pH=2,5 |
| 1 |
2,37 |
| 2 |
3,17 |
| 3 |
3,98 |
| 4 |
4,61 |
| 5 |
5,23 |
| 6 |
4,82 |
| 7 |
4,62 |
| 8 |
3,55 |
| 9 |
2,95 |
| 10 |
2,55 |
3.2. Efecto de la velocidad de agitaciónTOP
Los experimentos de elución se llevaron a cabo entre un rango de 0 a 400 rpm con 0,4 L de solución donde su concentración
de H2SO4 fue de 0,25 g L−1 con una masa de alginato de 80 mg y una temperatura de 25 °C. Esta solución acuosa fue la solución estándar de elución que
se utilizó posteriormente. Los resultados obtenidos son presentados en la Fig. 4, los cuales mostraron que la velocidad de agitación no tuvo un efecto significativo sobre la velocidad de disolución de níquel
para valores superiores a 300 rpm. Asimismo se utilizó una velocidad de 400 rpm para el resto de experimentos para asegurar
que la reacción de elución no sea controlada por la transferencia de masa.
|
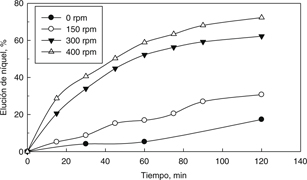 Figura 4. Efecto de la velocidad de agitación sobre la elución de níquel. Figura 4. Efecto de la velocidad de agitación sobre la elución de níquel.
|
|
3.3. Efecto de la temperatura sobre la velocidad de eluciónTOP
Los experimentos fueron llevados a cabo en un intervalo de temperatura de 2 a 80 °C. Los resultados son mostrados en la Fig. 5 donde se observa el efecto preponderante que tiene la temperatura sobre la velocidad de elución del níquel. Así, para una
temperatura de 8 °C la elución de níquel es lenta y solamente se obtiene un 28% de elución en 120 minutos, mientras que a
80 °C se alcanza una elución sobre el 93% al mismo tiempo.
|
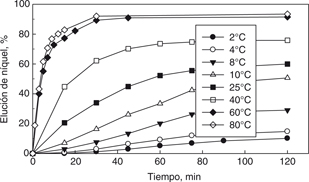 Figura 5. Efecto de la temperatura sobre la velocidad de elución de níquel. Figura 5. Efecto de la temperatura sobre la velocidad de elución de níquel.
|
|
También se puede observar que aun trabajando cerca del punto de solidificación del agua (0 °C), se puede obtener una significativa
elución de níquel llegando a valores de 10% a 120 minutos.
Las grandes diferencias observadas en las velocidades de elución de níquel desde PDAB pueden ser debidas a los cambios de
las constantes cinéticas que envuelven las velocidades de los procesos de elución.
3.4. Efecto de la concentración de ácido sulfúricoTOP
Se estudió el efecto de la concentración de H2SO4 sobre la velocidad de elución de níquel. Los resultados son mostrados en la Fig. 6. Claramente se observa que con bajas concentraciones de ácido sulfúrico, la elución de níquel es muy lenta llegando a valores
de elución de 4% para una concentración de 0,01 g L−1 de H2SO4 y en un tiempo de 120 minutos. Sin embargo, incrementando la concentración de ácido hasta 2,5 g L−1, se incrementa notablemente la elución de níquel alcanzando un valor de 84% en el mismo tiempo experimental. Se debe hacer
notar que utilizando una concentración de 0,005 g L−1 de H2SO4, no se observó elución alguna de níquel.
|
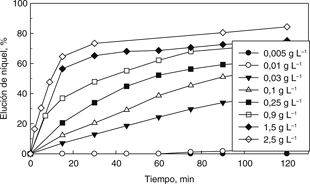 Figura 6. Efecto de la concentración de H2SO4 sobre la velocidad de elución de níquel. Figura 6. Efecto de la concentración de H2SO4 sobre la velocidad de elución de níquel.
|
|
Por otro lado, se analizó la composición química superficial de níquel sobre el PDAB. Se realizó el análisis por DRX sobre
las muestras cortadas con grafito; las partículas de PDAB fueron eliminadas desde los experimentos a tiempos de 30 y 120 minutos
para una concentración de H2SO4 de 0,25 g L−1. Cada uno de los dos puntos fue analizado utilizando el sistema EDS. Las mediciones son presentadas en la Fig. 7. La Tabla 2 muestra un resumen de los resultados de la composición de níquel sobre la superficie de las esferas. Dicha tabla muestra
que la composición promedio de níquel sobre la superficie de la partícula disminuye a medida que se incrementa el tiempo de
permanencia del PDAB en la solución, el cual coincide con los resultados resumidos en la Fig. 6. La disminución alcanzó un valor de alrededor de 6,6% del contenido de níquel por incremento del tiempo experimental desde
0 a 30 minutos; un mayor decrecimiento de níquel en la superficie se obtiene a un tiempo de 120 minutos, observándose un decrecimiento
de alrededor de 95%.
|
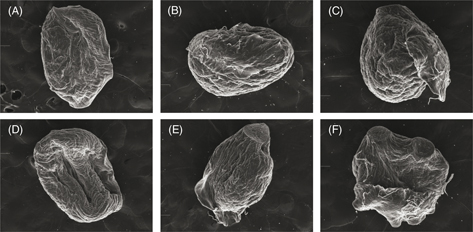 Figura 7. Micrografías BEI y mapeo del alginato; (A y D) Muestra original; (B y E) 30 minutos; (C y F) 120 minutos. Figura 7. Micrografías BEI y mapeo del alginato; (A y D) Muestra original; (B y E) 30 minutos; (C y F) 120 minutos.
|
|
Tabla 2. Concentración de Ni, expresada en %, sobre la superficie del alginato por análisis de EDS
| Partícula |
Punto |
Concentración de Ni (%) |
| Muestra original |
30 minutos |
120 minutos |
| 1 |
1 |
10,52 |
3,35 |
0,51 |
|
2 |
9,56 |
2,90 |
0,54 |
|
3 |
9,29 |
2,98 |
0,48 |
| 2 |
1 |
9,12 |
3,13 |
0,62 |
|
2 |
9,67 |
2,31 |
0,61 |
|
3 |
9,24 |
2,46 |
0,50 |
| Promedio |
|
9,53 |
2,98 |
0,52 |
3.5. Efecto de distintos reactivos ácidosTOP
Para conocer el efecto que tuvieron distintos reactivos ácidos sobre la velocidad de elución de níquel, se realizaron pruebas
con tres reactivos: HNO3, HCl y HClO4. Los resultados experimentales son mostrados en la Fig. 8, donde se puede apreciar que para los tres reactivos utilizados existió un efecto positivo en la elución de níquel. Así,
utilizando HNO3 se obtiene un 65,8% de elución a los 120 minutos, mientras que utilizando HCl se llegó a una elución de 56,2% en el mismo
tiempo. Las velocidades de elución, utilizando ambos reactivos (HNO3 y HCl), fueron similares a las curvas obtenidas con H2SO4. Sin embargo, al utilizar el reactivo HClO4, fue distinto el comportamiento de la curva de elución, el cual mostró una lentitud en la elución llegando a valores de 30,6%
de elución en un tiempo de 120 minutos. Por lo tanto, debido a la escasa bibliografía sobre la elución de níquel mediante
el uso de estos reactivos ácidos, la utilización de otros reactivos ácidos hace necesario desarrollar estudios anexos para
encontrar el efecto de éstos reactivos a bajas y mayores concentraciones.
|
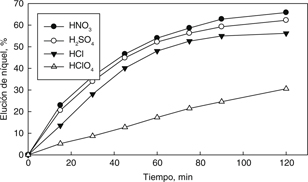 Figura 8. Efecto de diferentes reactivos ácidos sobre la elución de níquel. Figura 8. Efecto de diferentes reactivos ácidos sobre la elución de níquel.
|
|
3.6. Estabilidad del alginato con distintos números de ciclosTOP
Se estudió la estabilidad de las esferas de alginato en función del número de ciclos. Para este punto se realizaron pruebas
de extracción y elución a las mismas condiciones mencionadas anteriormente (Extracción: concentración inicial de Ni=17 mg
L−1, un valor de pH de 5,0, masa de alginato utilizada de 80 mg, temperatura de la solución de 25 °C y tiempo experimental de
360 minutos; Elución: concentración inicial de H2SO4=0,25 g L−1, masa de alginato de 80 mg, temperatura de 60 °C y tiempo experimental de 60 minutos). Los ciclos llegaron hasta un número
de cinco. Los resultados mostraron extracciones de hasta 75 mg g−1 y eluciones cercanas al 90%, para cada una de los ciclos. Estos resultados pusieron de manifiesto que el alginato podría
ser reutilizado manteniéndose las condiciones de trabajo. También se observó que el alginato mantuvo su estabilidad física,
sin desprendimiento de su estructura ni tampoco destrucción de ella. Con estas pruebas se contempla realizar trabajos a futuro
mediante un sistema en continuo para estudiar la cama de esferas, número de ciclos mayores y otras variables.
3.7. Cinética de elución de níquelTOP
El proceso de elución de níquel fue notablemente afectado por la temperatura. Por lo tanto, se sugiere que el proceso de elución
está controlado por la reacción química en la superficie. Asimismo, asumiendo el control de la reacción sobre la superficie,
se aplicó a este proceso la ecuación de velocidad de núcleo recesivo para una partícula de PDAB de radio inicial ro para una concentración constante de reactantes. Tal ecuación fue descrita como (Shon y Wadsworth, 1979):

donde α es la fracción de níquel eluída, t es el tiempo de elución, y kapp es la constante cinética aparente dada por la siguiente expresión general:

donde k1 es la constante de velocidad lineal, CH2SO4 es la concentración en la solución de ácido sulfúrico y m es el orden de reacción aparente
La Fig. 9 muestra un gráfico de 1-(1-α)1/3 como una función del tiempo para los datos experimentales obtenidos desde la Fig. 5 en el rango de temperatura de 2 a 80 °C. Una aproximación similar fue utilizada para los resultados experimentales concernientes
al efecto de la concentración de ácido sulfúrico. Se puede observar en esta figura un buen ajuste lineal de los datos cinéticos
con coeficientes de regresión, R2, desde 0,96 a 0,99 para todo el rango de temperatura, indicando que se puede aplicar la Ec. (2). Los valores de las constantes
cinéticas aparentes a varias temperaturas fueron obtenidas desde las pendientes de las líneas rectas y son mostradas en la
Tabla 3.
|
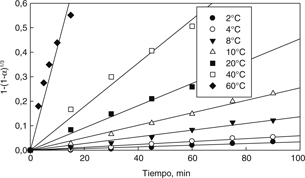 Figura 9. Cinética de elución de níquel en una solución de H2SO4 para las condiciones de elución de la Fig. 5. Figura 9. Cinética de elución de níquel en una solución de H2SO4 para las condiciones de elución de la Fig. 5.
|
|
Tabla 3. Constantes de velocidad para la elución de níquel
| T [°C (K)] |
1000/T (1/K) |
kapp |
-ln kapp |
| 2 (275) |
3,636 |
0,00034 |
7,9866 |
| 4 (277) |
3,610 |
0,00059 |
7,4354 |
| 8 (281) |
3,559 |
0,00136 |
6,6003 |
| 10 (283) |
3,534 |
0,00254 |
5,9756 |
| 20 (293) |
3,413 |
0,00455 |
5,3926 |
| 40 (313) |
3,195 |
0,00860 |
4,7560 |
| 60 (333) |
3,003 |
0,03989 |
3,2216 |
Por lo demás, el orden de reacción m fue calculado desde los datos cinéticos sobre el efecto de la concentración de ácido sulfúrico. La Fig. 10 muestra los datos experimentales para varias concentraciones de H2SO4 calculados de acuerdo a la Ec. (2), y los valores de kapp fueron utilizados para representar un gráfico de ln kapp vs ln CH2SO4 como se muestra en la Fig. 11. Los datos de concentración de H2SO4 fueron transformados a concentración molar (M). En la Fig. 11 se observa una relación lineal con un R2 igual a 0,92 y una pendiente que indica que la reacción es de orden 0,33 con respecto a la concentración de ácido sulfúrico.
|
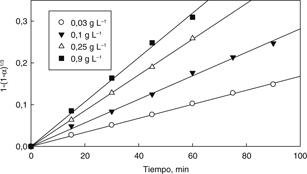 Figura 10. Cinética de elución a una temperatura de 25 °C a diferentes concentraciones de H2SO4 para condiciones de elución de la Fig. 6. Figura 10. Cinética de elución a una temperatura de 25 °C a diferentes concentraciones de H2SO4 para condiciones de elución de la Fig. 6.
|
|
|
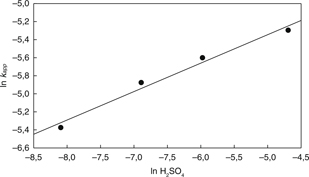 Figura 11. Orden de reacción con respecto a la concentración de H2SO4. Figura 11. Orden de reacción con respecto a la concentración de H2SO4.
|
|
Seguidamente se calcularon las constantes de velocidad intrínseca k1 para el rango de temperaturas estudiado mediante el uso de los valores de las constantes cinéticas aparentes obtenidas desde
la Fig. 5 y el valor de m igual a 0,33. La Tabla 4 muestra ambas constantes de velocidad aparente e intrínseca para las temperaturas estudiadas. A continuación, los valores
calculados de las constantes intrínsecas k1 fueron utilizados para obtener el gráfico de Arrhenius mostrado en la Fig. 12. Esta figura muestra un buen ajuste lineal (R2>0,92) de las constantes cinéticas intrínsecas de cada temperatura. La energía de activación calculada fue de 54,5 kJ mol−1 para el rango de temperatura entre 2 y 60 °C, el cual es un típico valor para una reacción controlada por reacción química
en la superficie.
|
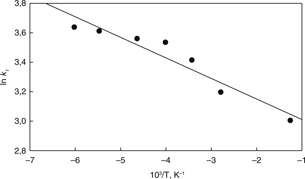 Figura 12. Gráfico de Arrhenius para la elución de níquel en una solución de ácido sulfúrico. Figura 12. Gráfico de Arrhenius para la elución de níquel en una solución de ácido sulfúrico.
|
|
Tabla 4. Constantes de velocidad para la elución de níquel en el rango de temperaturas de 2 a 60 °C para una concentración de ácido
sulfúrico de 2,55×10−3 M
| T (°C) |
kapp (min−1)
|
k1 (min−1)
|
| 2 |
0,00034 |
0,00244 |
| 4 |
0,00059 |
0,00423 |
| 8 |
0,00136 |
0,00976 |
| 10 |
0,00254 |
0,01822 |
| 20 |
0,00455 |
0,03264 |
| 40 |
0,00860 |
0,06169 |
| 60 |
0,03989 |
0,28619 |
Así, la cinética de elución de iones de níquel en un ambiente de ácido sulfúrico puede ser representada por la siguiente ecuación:
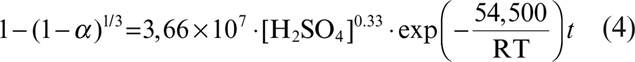
donde R es igual a 8,314 J mol−1 K−1, [H2SO4] está en concentración molar, t es en minutos y k1=3,66×107 M−0,33 min−1.
4. CONCLUSIONESTOP
De los resultados de esta investigación, se pueden enumerar las siguientes conclusiones:
| - |
La elución de níquel desde esferas de alginato se produce por un mecanismo de intercambio iónico entre protones e iones de
níquel.
|
| ͍ |
Al incrementar la velocidad de agitación de la solución se produce un aumento de la elución de iones de níquel debido a que
la transferencia de masa no juega un rol importante.
|
| - |
El aumento de la temperatura y concentración de ácido sulfúrico permite incrementar la elución de níquel hasta llegar a valores
de 93% de elución a una temperatura de 80 °C y concentración de H2SO4 de 0,25 g L−1.
|
| - |
La cinética de elución de níquel fue analizada utilizando un modelo 1-(1-α)1/3=kappt, que permitió la determinación de la dependencia de la temperatura y concentración del ácido sulfúrico sobre la velocidad
de elución.
|
| - |
Se encontró que la reacción de intercambio iónico es controlada por la reacción química en la superficie y es de orden 0,33
con respecto a la concentración de ácido sulfúrico y la energía de activación fue determinada como 54,5 kJ mol−1 para el rango de temperatura entre 2 y 60 °C.
|
REFERENCIASTOP
| ○ |
Anoop, K., Sreejalekshmi, K.G., Baiju, R.S. (2011). Nickel(II) adsorption onto biomass based activated carbon obtained from sugarcane bagasse pith. Bioresource Technol. 102 (22), 10239–10247. http://dx.doi.org/10.1016/j.biortech.2011.08.069.
|
| ○ |
Aracena, A., Guajardo, N., Ibáñez, J.P., Jerez, O., Carlesi, C. (2015). Uptake of nickel ions from aqueous solutions using protonated dry alginate beads. Can. Metall. Quart. 54 (1), 58–65, http://dx.doi.org/10.1179/1879139514Y.0000000152.
|
| ○ |
Belova, D.A., Lakshtanov, L.Z., Carneiro, J.F., Stipp, S.L.S. (2014). Nickel adsorption on chalk and calcite. J. Contam. Hydrol. 170, 1–9. http://dx.doi.org/10.1016/j.jconhyd.2014.09.007.
|
| ○ |
Ibáñez, J.P., Umetsu, Y. (2002). Potential of protonated alginate beads for heavy metals uptake. Hydrometallurgy 64 (2), 89–99. http://dx.doi.org/10.1016/S0304-386X(02)00012-9.
|
| ○ |
Ibáñez, J.P., Umetsu, Y. (2008). Uptake of Cd2+ from aqueous solutions using protonated dry alginate beads. Can. Metall. Quart. 47 (1), 45–50. http://dx.doi.org/10.1179/cmq.2008.47.1.45.
|
| ○ |
Ibáñez, J.P., Aracena, A. (2014). Uptake of Zn2+ from dilute aqueous solutions using protonated dry alginate beads. Can. Metall. Quart. 53 (1), 82–87. http://dx.doi.org/10.1179/1879139513Y.0000000104.
|
| ○ |
Malanis, S., Katsou, E. (2013). A review of zinc and nickel adsorption on natural and modified zeolite, bentonite and vermiculite: Examination of process parameters, kinetics and isotherms. J. Hazard. Mater. 252–253, 428–461. http://dx.doi.org/10.1016/j.jhazmat.2013.03.024.
|
| ○ |
O’Connell, D.W., Birkinshaw, C., O’Dwyer, T.F. (2008). Heavy metal adsorbents prepared from the modification of cellulose: A review. Bioresource Technol. 99 (15), 6709–6724. http://dx.doi.org/10.1016/j.biortech.2008.01.036.
|
| ○ |
Roine, A. (1999). HSC Chemistry 6.0 Sofware, OutoKumpu Research Py, Pori, Finlandia.
|
| ○ |
Shon, H.Y., Wadsworth, M.E. (1979). Rate processes of extractive metallurgy, Plenum Press, New York, USA.
|
| ○ |
Vocciante, M., Trofa, M., Rodríguez, P., Giraldo, L., D’Auria, T., Moreno, J.C., Erto, A. (2014). A rigorous procedure for the design of adsorption units for the removal of cadmium and nickel from process wastewaters. J. Clean. Prod. 77, 35–46. http://dx.doi.org/10.1016/j.jclepro.2013.12.001.
|
| ○ |
Xia, L., Hu, Y., Zhang, B. (2014). Kinetics and equilibrium adsorption of copper(II) and nickel(II) ions from aqueous solution using sawdust xanthate modified with ethanediamine. T. Nonferr. Metal. Soc. China 24 (3), 868–875. http://dx.doi.org/10.1016/S1003-6326(14)63137-X.
|
Figura 1. Diagrama Eh-pH del sistema Ni-H2O a una concentración de Ni=2,9×10−4 mol L−1. Líneas finas: equilibrios obtenidos a 2 °C. Líneas gruesas: equilibrios obtenidos a 25 °C. Líneas Entrecortadas: equilibrios
obtenidos a 55 °C.